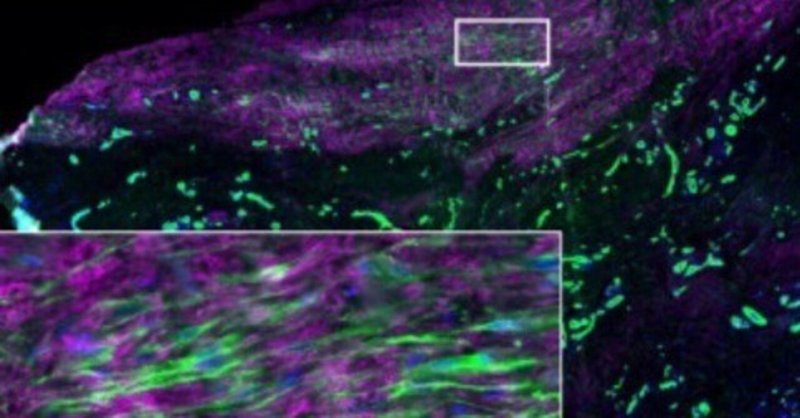
腱のリモデリング時の線維化とペリオスチン動態
組織修復とペリオスチン
腱は、筋肉から骨への力の伝達を通じて骨格の動きを促進し、階層的に組織されたコラーゲンに富んだマトリックス構造により、計り知れない生理学的負荷に耐えることができます。しかし、腱の損傷は一般的です。たとえば、引張過負荷が 1 回発生しただけでもアキレス腱の自然断裂を引き起こす可能性がありますが、最も頻繁に発生する腱は手の屈筋腱です。急性外傷によって損傷することは少なくない。腱損傷により線維性治癒反応が開始され、損傷後の完全な機能回復が妨げられることがよくあります 。他の軟組織では、治癒過程で生成される細胞外基質 (ECM) の分解と除去によって線維化の解消が達成されますが、この結果は、代わりに ECM を再構築する必要がある腱などのコラーゲン組織には適していません。さらに、線維血管瘢痕組織の反応により、治癒した腱は健康な腱より機械的に劣り、再断裂または修復不全の発生率が増加します。この負担にもかかわらず、線維症の治癒プロセスは十分に理解されていないため、腱の治癒を改善するためのコンセンサスのある生物学的治療が不足しています。
筋線維芽細胞は、生理学的創傷治癒と組織線維化の両方の重要な制御因子です。筋線維芽細胞は高度な細胞外マトリックス (ECM) 産生が可能ですが、その固有の収縮能力が創傷マトリックスの硬さを調節し、それによってこのマトリックス内に埋め込まれた他の細胞の挙動を調節します。筋線維芽細胞は通常、機械感受性ストレス線維におけるαSMAの新規発現によって定義され、局所的なECM摂動の感知と応答を促進します。筋線維芽細胞は、ECMの合成とリモデリングによる適切な創傷治癒に不可欠ですが、損傷部位での筋線維芽細胞の不適切な蓄積および/または残留は、線維化進行へのスイッチの主な引き金となります。筋線維芽細胞は、ECM からの潜在的な TGF-β の放出を駆動することができますが、TGF-β は筋線維芽細胞の分化を促進し、それによって線維化促進性のフィードバック ループを作成します。さらに、治癒の生理学的解決は、アポトーシスまたは基礎線維芽細胞状態への復帰を介した筋線維芽細胞クリアランスの欠如によって阻害されます 。したがって、筋線維芽細胞の挙動を調節することは、腱損傷時の線維化を防ぐための魅力的な選択肢です。しかし、 αSMA発現を調節するための遺伝子マウスモデルによる筋線維芽細胞機能の操作は、いくつかの要因によって混乱します。αSMAは、血管系の平滑筋細胞などの他の細胞型によって発現されます 。
したがって、αSMA-Creドライバーを使用するマウスモデルはオフターゲット効果を引き起こす可能性があり、筋線維芽細胞運命のより翻訳的に扱いやすいマーカーの同定が必要です。最近、マトリックス細胞タンパク質であるペリオスチン(Postn) の発現が、心臓線維症における活性化筋線維芽細胞の潜在的なマーカーとして同定されました。ペリオスチン系統 (Postn Lin ) 細胞他の研究では、ペリオスチンマトリックス自体が筋線維芽細胞の分化を促進および維持し、組織の線維化を媒介することが証明されています。 したがって、我々は、ペリオスチン細胞が腱内の同様の線維化促進性筋線維芽細胞集団に寄与しているかどうかを判断し、腱治癒中の筋線維芽細胞の分化と持続におけるペリオスチンマトリックスのニッチな役割を定義し、腱形成を破壊する治療の可能性を評価しようとしました。
ペリオスチン系統の細胞は、腱治癒中に天然の腱治癒組織接合部で一過性の筋線維芽細胞集団を生成する
ペリオスチン系統 (Postn Lin ) 細胞が持続性筋線維芽細胞であるペリオスチンMCM+を生成するかどうかを確認するには、Rosa-Ai9 F/+マウスには、ペリオスチン細胞を継続的に標識して追跡するために、腱修復手術時にタモキシフェンの摂取を開始しました。ペリオスチン細胞は、損傷を受けていない対側の対照腱では観察されませんでした。D7までに、ペリオスチン細胞はエピテノン領域に沿って拡大し、いくつかの細胞は損傷した腱の端に近いαSMAと共局在することが判明した。D14 では、ペリオスチンの集団。αSMA+ 細胞は架橋瘢痕組織内にも観察されました。しかし、リモデリング段階(D28)中、腱端の周囲および架橋組織のペリオスチン細胞では最小限のαSMA発現が観察され、ペリオスチン細胞は治癒全体を通じて肥厚したエピテノンに保持されました。
興味深いことに、筋線維芽細胞プールに寄与するペリオスチン細胞の割合の減少傾向が時間の経過とともに観察された一方で、有意差は確認されなかった。これは、ペリオスチン由来の筋線維芽細胞に局所的な変化がある可能性があることを示唆している。時間が経っても、治癒領域全体にわたる筋線維芽細胞の運命に寄与するペリオスチン細胞の割合は、時間の経過とともに劇的に変化することはありません。
ペリオスチンマトリックスは、一次腱細胞の活性化と筋線維芽細胞の分化を誘導する
ペリオスチンマトリックスと筋線維芽細胞との密接な関係を考慮して、我々は、ペリオスチンが腱細胞の活性化と筋線維芽細胞の分化を促進する能力をインビトロで評価した。線維芽細胞活性化マーカーである線維芽細胞活性化タンパク質(FAP)の発現は、ペリオスチンでコーティングされたプレート上で培養された腱細胞において有意に増加しました(約14倍、p <0.01)が、対応するScx発現の増加はありませんでした(p = 0.3)。活性化は、腱誘発性の潜在的な変化なしに起こっています。さらに、対照と比較して、 ペリオスチン でコーティングされたプレート上の腱細胞では、 αSMA 発現の有意な増加 (2 倍、 p = 0.0009) が観察されました。Col3a1 発現の変化は観察されませんでした ( p = 0.49) 。ペリオスチンでコーティングされたプレート上で培養された腱細胞は、αSMAのストレスファイバーへの取り込みによって評価されるように 、コラーゲン単独で増殖した腱細胞と比較して、有意に高度な筋線維芽細胞分化を受けました(+47%増加、p = 0.011)。対照培養物中のほとんどの腱細胞はいくらかのαSMA発現を有していたが、αSMAがストレスファイバーに取り込まれた細胞のみが成熟筋線維芽細胞として計数された。まとめると、これらのデータは、ペリオスチンが細胞外ニッチとして機能し、細胞マトリックスクロストークを介して線維芽細胞の活性化と筋線維芽細胞の分化を増強する可能性があることを示唆しています。ペリオスチンが活性化と分化を促進する潜在的なインテグリン媒介機構を定義するために、ペリオスチンでコーティングされたプレート上で培養された腱細胞におけるインテグリン発現の変化を対照と比較して評価しました。コントロールと比較して、ペリオスチンマトリックス上で培養した腱細胞では、インテグリン β1 (ITGB1) 発現領域および平均蛍光強度 (MFI) の有意な増加が観察されました 。さらに、ペリオスチンでコーティングされた培養物では、CD61/インテグリン β3 MFI の有意な増加が観察されました。しかし、CD61発現領域の群間差は観察されず、インテグリンβ5(ITGB5)およびCD51/インテグリンαV発現またはMFIの群間差は観察されなかった。
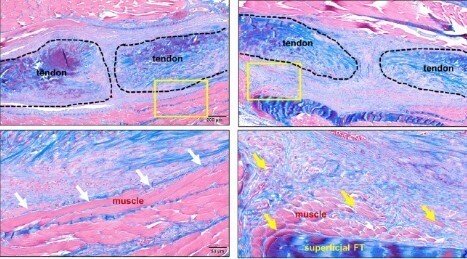
ペリオスチンマトリックス生成の阻害により腱の機能回復が損なわれる
ペリオスチンマトリックスがインビトロで腱細胞と筋線維芽細胞の分化を促進するのに十分であることを示したので、Postn Lin細胞の枯渇とその後のペリオスチンマトリックス生成の阻害を介して筋線維芽細胞の持続を破壊する治療の可能性を調査しました。このアプローチは、確立されたペリオスチンマトリックスを破壊するには十分ではなく、αSMA+筋線維芽細胞の含有量を変化させることはなかった。ペリオスチンマトリックスの持続性と筋線維芽細胞環境への影響の欠如と一致して、D7 ~ 10 の細胞枯渇では腱の滑走機能の変化 や機械的特性の再獲得 は観察されませんでした。
驚くべき発見の 1 つは、損傷後の肥厚したエピテノンにペリオスチン細胞が存在することでした。最近の研究は、腱原性前駆細胞集団と損傷部位の周囲に現れる前線維化集団を含む、エピテノン細胞の二重運命の可能性を実証しました。継続的に標識された ペリオスチン細胞は、損傷後 D28 までに、肥厚したエピテノン内および架橋組織の縁に沿って強力に存在することを示します。
興味深いことに、筋線維芽細胞は通常、主要な線維化促進集団として関与しているが、エピテノン由来の外部被膜集団には筋線維芽細胞が存在しないこと、およびこの領域におけるペリオスチンマトリックスおよびポストンリン細胞の同時濃縮は、これまで評価されていなかった非筋線維芽細胞の役割を示唆している。
ペリオスチン細胞が腱の治癒中に他の組織と比較して独特の役割を果たすことを示しています。治癒中の腱では、ペリオスチン細胞のサブセットが、心線維症中に観察される持続的な集団ではなく、αSMA+ 筋線維芽細胞の一過性の集団を生成します。さらに、成熟ペリオスチンマトリックスの作製は、治癒中の筋線維芽細胞の分化と持続を制御する重要なニッチとして機能し、腱周囲癒着形成に関連する外部エピテノン由来組織にはペリオスチンマトリックスとポストンリン細胞が豊富であることを実証しました。したがって、我々は、線維性腱治癒の重要な調節因子としてのペリオスチンマトリックスニッチの調節と、腱治癒プロセスを強化するための重要な治療標的としてのこのマトリックスの操作を確立した。
ハイライト
腱損傷は主要な臨床問題であり、治癒中に瘢痕組織が大量に沈着することによって患者の転帰が悪化します。筋線維芽細胞は、損傷後の構造的完全性の初期回復において重要な役割を果たします。しかし、筋線維芽細胞の活動が持続すると、線維性瘢痕組織形成への移行が促進されます。したがって、筋線維芽細胞の持続を破壊することが重要な治療目標です。筋線維芽細胞は通常、αSMA+ストレスファイバーの存在によって定義されますが、αSMAは血管系を含む他の細胞タイプでも発現します。したがって、αSMA発現の破壊による筋線維芽細胞の動態の調節は、翻訳的に維持可能なアプローチではありません。最近の研究により、ペリオスチン系統 (Postn Lin ) 細胞が心臓線維症関連筋線維芽細胞の前駆体であることが証明されました。これとは対照的に、ペリオスチン細胞が腱の機能的治癒に必要な一過性のαSMA+筋線維芽細胞集団に寄与していること、およびペリオスチンが筋線維芽細胞の分化と持続を促進する支持的なマトリックスニッチを形成していることを示す。まとめると、ペリオスチンマトリックスニッチが筋線維芽細胞の運命と持続性の重要な調節因子であり、腱の再生治癒を促進するための治療的操作の標的となり得ることを特定する。
★ペリオスチン系統細胞は、一過性ではあるが持続性ではない筋線維芽細胞集団に寄与します。
★ペリオスチンは、筋線維芽細胞の分化を支援するニッチとして機能します。
★ペリオスチンは機能的な腱の治癒に必要です
この記事が気に入ったらサポートをしてみませんか?
