神経系機能不全のオートファジー
神経変性とオートファジー
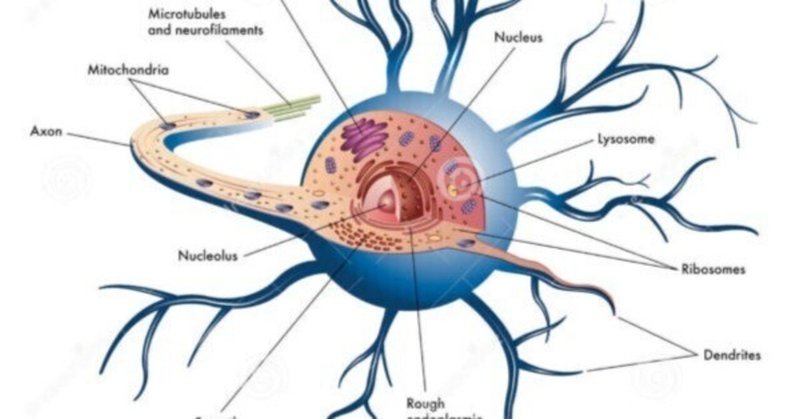
オートファジーには、オートファゴソームと呼ばれる新たに形成された二重膜小胞が長寿命タンパク質またはミトコンドリアなどの細胞小器官を飲み込み、それらを分解のためにリソソームに移す細胞内恒常性プロセスが関与します(Ravikumar et al.、2010 )。オートファジー機構は種を超えて保存されていますが、脳は栄養とエネルギーの供給を調節する正確な機構を備えているため、基礎的なオートファジーの流れは健康なニューロンでは比較的遅い発見でした (Boland & Nixon, 2006 )。実際、おそらく、脳におけるオートファジーの関連性を最初に実証したのは、オートファジー関連タンパク質 5 および 7 (Atg5、Atg7) ノックアウトマウスでの発見でした (Hara et al., 2006;Komatsu et al. , 2006 )。ここで、Atg7欠損は、顕著な行動欠陥およびニューロンにおけるポリユビキチン化タンパク質の蓄積を伴う、大脳皮質および小脳皮質における大規模なニューロン損失を引き起こした(Komatsu et al., 2006 )。現在、脳におけるオートファジーの重要性に関する文献が急速に増えており、オートファジーと関連するリソソーム機能はニューロンの健康維持の決定要因であると考えられています。遺伝子変異および/または潜在的に有毒な凝集傾向のあるタンパク質によって引き起こされるオートファジーの機能不全は、いくつかのヒトの神経変性疾患の特徴です。オートファジー細胞小器官のクリアランス、特に損傷したミトコンドリアのクリアランス(マイトファジー)は、脳特有のエネルギー依存性と、このプロセスがさまざまな病態で機能不全に陥っている疑いがあるため、現在かなりの注目を集めている(例えば、Van Laar & Berman、2013 )。したがって、潜在的に有毒な破片や損傷した細胞小器官の除去を助ける薬物が、現在潜在的な治療法として注目を集めていることは驚くべきことではありません(Boland et al., 2018 ; Menzies et al. , 2017 )。

オートファジーに関連する、またはオートファジーによって誘発され、アポトーシスやネクローシスなどの他の標準的な細胞死機構の存在または非存在下で発生する細胞死様式を定義するための「オートファジー細胞死」という用語の曖昧な使用について議論が行われてきました。オートファジー関連細胞死、オートファジー媒介細胞死、オートファジー依存性細胞死などのより正確な表現を使用し、プロセスの関与レベルを決定するためのより厳密な分析を行うことが推奨されています(Klionsky et al. 、2016年)。これらの留保にもかかわらず、いくつかの研究はオートファジーが実際に神経細胞死を引き起こす可能性があることを実証しており、特定の状況下ではオートファジー阻害が治療選択肢として考慮されるべきであることを示しています(Liu & Levine、2015 )。脳に影響を与える病理学的状態におけるオートファジーの重要な役割を説明し、治療の標的としてのその可能性について議論することを提案しています。成人の脳と脆弱な未熟な新生児の脳における低酸素性虚血性損傷に対するオートファジーの寄与を示し、周産期仮死を治療するための有望なアプローチとしてオートファジー阻害の出現を強調しています。
多機能タンパク質 PINK1 とパーキン、および特定の形態のパーキンソン病 (PD) の生理病理の中心であると疑われるストレス誘発性マイトファジー プログラムの調節におけるそれらの役割に特化しています。オートファジー活性化因子リルメニジンの具体例と、MND の神経モデルおよびマウスモデルにおけるその不一致な効果を例に挙げて、脳疾患におけるオートファジーを標的とした治療アプローチに関連する複雑さを説明します。
傷害の重症度、機能不全のオートファジーおよび低酸素性虚血性損傷
神経損傷のパターンは、損傷の種類、強度、持続時間、特に酸化ストレスと興奮毒性、そしておそらく有毒タンパク質凝集体の負荷に大きく依存するという既存の文献があります (Galluzzi, Bravo-San Pedro, Blomgren, & Kroemer, 2016 ))。実際、我々は、培養皮質ニューロンにおいて、酸化ストレス因子である過酸化水素によって誘導されるカスパーゼ非依存性プログラム細胞死が、3-メチルアデニンによって大幅に弱められ、Atg7 および Beclin1 (BECN1) に対する短鎖干渉 RNA (siRNA) によるノックダウンによって大幅に軽減されることを発見しました。特定のオートファジーおよび細胞死の形態学的マーカーの使用。この多様な証拠は、異なる相互作用細胞死経路を備えたモデルにおけるオートファジー媒介ニューロン死、およびカスパーゼ非依存性プログラム細胞死の関与を裏付けている (Higgins, Devenish, Beart, & Nagley, 2011 )。損傷強度のニューロンにおける決定的役割の概念と一致して、重度の酸化ストレスでは、オートファジー関連細胞死が損傷の進行に対して有効でなかったにもかかわらず、Atg7 を対象とした siRNA の効果が低く、重度の酸化ストレスでは異なる形態の細胞死の間でさらに広範なクロストークが存在しました (Higgins、Devenish、Beart、および Nagley、2012 年)。さらに、我々は広範なマイクロアレイデータの比較分析で、酸化ストレスと興奮毒性の下流で調節されるオートファジー・リソソーム遺伝子には多くの共通点があり、これらの事象がオートファジーとオートファジー・リソソーム経路の下流阻害につながることを発見した(Yap et al.、2016)。
酸化ストレスと興奮毒性の両方が低酸素性虚血性損傷(HI)に寄与することが文書化されていることを考えると(Khoshnam、Winlow、Farzaneh、Farbood、およびMoghaddam、2017)、脳卒中へのオートファジーの動員の可能性に関する研究は、私たちの研究の論理的な延長でした。
実際、脳卒中の病歴を持つ患者の死後のヒト脳組織で、微小管関連タンパク質軽鎖3(LC3)免疫標識されたオートファジー空胞が豊富に存在することが判明した(Frugier et al., 2016 )。高密度セクエストソーム 1 (SQSTM1) 標識も見つかりましたが、LC3 標識後に見出されたものとは異なり、免疫陽性ニューロンは境界領域からさらに離れていました。SQSTM1 の mRNA とタンパク質のレベルも増加していました。この SQTM1 レベルの上昇はオートファジーの阻害を示している可能性がありますが、HI におけるオートファジー - リソソーム系の動員に関する現在の理解はまだ初期段階にあり、細胞破片や損傷したタンパク質の「負荷」が影響していることを示唆する既存の証拠があります。オートファジーの動員様式を決定する可能性がある(Li et al., 2010 ; Shi et al., 2012 ; Wen et al., 2008)。明らかに、HI の臨床管理用の薬剤が不足していることを考えると、オートファジーとその管理は魅力的なターゲットとなります。
パーキンソン病とオートファジー
マイトファジーは、栄養剥奪または毒素誘発性ミトコンドリア損傷後のカスパーゼ阻害剤の存在下でのアポトーシス誘導時など、特定のストレス条件下でのミトコンドリアの選択的オートファジーを表す比較的最近の用語です (Elmore、Qian、Grissom、および Lemasters、2001 ; Kissova ) 、Deffieu、Manon、& Camougrand、2004 ; Lemasters、2005 ; Tolkovsky、Xue、Fletcher、& Borutaite、2002)、または発達中の心臓における代謝再シャッフル(Gong et al.、2015)または赤血球の成熟(Sandoval et al., 2008 ; Schweers et al., 2007)。ミトコンドリアのセリン/スレオニンキナーゼPINK1とユビキチンタンパク質リガーゼParkin(常染色体劣性型のPDで変異した2つの遺伝子( PINK1とPARK2)の産物)が共同して細胞内の脱分極ミトコンドリアのクリアランスを促進することが判明したとき、マイトファジーが神経変性に関連するようになった。プロトノフォアのシアン化カルボニル m-クロロフェニル ヒドラゾンで処理した細胞株 (Geisler et al., 2010 ;matsuda et al., 2010 ; Narendra et al., 2010 ; Narendra,Tanaka,Suen,&Youle, 2008 )。現在では、呼吸鎖の特異的阻害剤、ミトコンドリアマトリックスにおける折り畳まれていないタンパク質ストレス、ミトコンドリアタンパク質輸入経路の障害など、多くのストレス関連刺激がこのプログラムを活性化することがわかっています(Barini et al., 2018 ; Bertolin et al . ., 2013 ; Fiesel, James, Hudec, & Springer, 2017 ; Greene et al., 2012 ; Jin et al., 2010 ; Jin & Youle, 2013 ; Wang et al., 2011 )。これらの条件は、ミトコンドリアへのPINK1の輸入を損ない、ミトコンドリアタンパク質の大部分が細胞小器官に入るミトコンドリア外膜(TOM)のトランスロカーゼの近くにあるミトコンドリア外膜(OMM)上での蓄積を促進する(Hasson et al.、2013 ; Lazarou、Jin、Kane、および Youle、2012 ; Okatsu et al.、2013)。これは、PINK1依存性のパーキンの動員と活性化、OMMの多くのタンパク質のユビキチン化、ミトファジーのためにミトコンドリアを刺激するためのオートファジー受容体と上流のオートファジー関連タンパク質の動員など、一連の出来事を引き起こす(レビュー:マクウィリアムズ & ムキット、2017 ; 関根 & ユール、2018 ; トゥルーバン、ホウ、コールフィールド、フィーゼル、スプリンガー、2017)。これらの現象は、ミトコンドリアと小胞体 (ER) の間の界面の近くで発生します (Gelmetti et al., 2017 ; Yang & Yang, 2013 )、細胞内区画は神経変性にますます関与しています (Erpapazoglou、Mouton-Liger、および Corti による総説) 、2017年)。この界面は、パーキン欠損マウスおよびPARK2変異患者の細胞では、パーキン基質およびERミトコンドリア結合タンパク質ミトフシン2(Mfn2)の蓄積により混乱している(Gautier et al., 2016 )。パーキンによるMfn2のユビキチン化、Mfn2複合体の分解、ERからのミトコンドリアの解離は、マイトファジーの開始に役立つ(McLelland et al., 2018)。これらの事象はおそらく、ダイナミン関連GTPase Drp1によって操作され、ER-ミトコンドリア界面によって調節される、損傷したミトコンドリアがネットワークの残りの部分から分離されることに付随して起こるものである(Buhlman et al., 2014; Friedman et al . , 2011 ;タナカら、2010年;ツイッグら、2008年)。Drp1は、脱分極したミトコンドリア上でPINK1とParkinによって協力的にリクルートされ、ミトコンドリア分裂とミトファジーがER-ミトコンドリア界面で調整されていることを示唆している。

脳病理学の治療標的としてオートファジーに焦点を当てる
オートファジーの制御とその多様な制御機構についての理解が深まり、オートファジーが有毒な凝集体や損傷した細胞小器官を除去するための複数の治療選択肢を持つユニークな標的であるという認識が高まったことにより、オートファジーの臨床応用性に対する関心が異常に高まっています。 (例: (Feng, Chen, & Shen, 2017 ; Tramutola, Lanzillotta, & Domenico, 2017 ) (Boland et al., 2018 ; Lipinski, Wu, Faden, & Sarkar, 2015 ; Maiese, 2016 ; Rubinsztein, Bento, & Deretic, 2015 ). 実際、これらのレビューは、アルツハイマー病や外傷性脳損傷のような病理学の異なるトピックに関連しており、そのような治療選択肢の幅広い適用可能性を反映しています。 de Force は、複数のクラスの薬物とオートファジー機構を制御する潜在的な分子標的を概説しました (Rubinsztein、Gestwicki、Murphy、および Klionsky、2007 )。我々は、ハンチントン病のマウスモデルにおいて有益な作用があることが報告された後、mTOR非依存性機構を介して作用すると考えられるFDA承認薬リルメニジンの存在に気づきました(Rose et al., 2010 )。当時、私たちは 3,4-メチレンジオキシメタンフェタミン (エクスタシー) によるセロトニン (5-HT) ニューロンの損傷について研究していました。
(1) アンフェタミンに対する脳の反応にはオートファジーが関与していると考えられていたた (Galluzzi et al. 、2016 )、
(2) 5-HT 縫線核にはリルメニジン結合部位が存在する (King、Gundlach、および Louis、1995 )
オートファジーの長寿命タンパク質では、タンパク質の凝集体または損傷した細胞小器官が、リソソームで分解される前にオートファゴソームと呼ばれる小胞に飲み込まれます。オートファジーの機能不全は、誤って折りたたまれたタンパク質や機能不全のミトコンドリアが蓄積するいくつかの神経変性疾患の特徴です。特定の条件下では、過剰なオートファジーも脳損傷を悪化させる可能性があります。脳に影響を与える病理学的状態においてオートファジーが果たす重要な役割を説明するために具体的な例を示し、潜在的な治療的意義について示した。オートシスと呼ばれる特異なタイプのオートファジー依存性細胞死が、周産期仮死および未熟な脳に対する低酸素性虚血性損傷の転帰を改善するための有望な標的として注目されている。オートファジー阻害が放射線療法による若い脳への損傷を防ぐ可能性があるという根拠がある。生体内でミトファジーが活性化される生理学的条件については議論があるにもかかわらず、セリン/スレオニンキナーゼPINK1とユビキチン-タンパク質リガーゼParkinによって媒介されるマイトファジーが、パーキンソン病に潜在的に関連する機構であることを特定した研究を要約した。最後に、オートファジー誘導剤リルメニジンと、細胞培養および運動ニューロン障害のマウスモデルにおけるその矛盾した効果の例を用いて、疾患の段階と攻撃性、損傷または有毒物質の負荷などの側面を考慮することは重要。適切な薬剤、治療期間、治療期間を選択する際には、細胞の成分を考慮する必要があります。
この記事が気に入ったらサポートをしてみませんか?
